世界初 「光で駆動する巨大イオンチャネルタンパク質」を藻類から発見 ―深部脳領域の新たな診断・治療法の開発への応用に期待―
東京大学
名古屋工業大学
香川大学
科学技術振興機構
発表のポイント:
- 幅広い種類の藻類が光エネルギーを使ってイオンを輸送する、巨大イオンチャネルタンパク質「ベストロドプシン」を持つことを世界で初めて発見しました。
- ベストロドプシンは光を捉えるロドプシン(注1)と、イオンを輸送するベストロフィン(注2)から成り、さらにベストロドプシン同士が集まることで大口径のイオンチャネルを持つ、巨大な複合体を形成することを発見、光に応答してイオンチャネルが開き、陰イオンが輸送される一連のメカニズムを解明しました。
- 本成果は、光遺伝学(オプトジェネティクス、注3)分野への応用や、視覚再生医療、心疾患治療のための新たな分子ツールとしての利用が期待されます。
発表概要:
東京大学物性研究所の井上圭一准教授、名古屋工業大学大学院工学研究科およびオプトバイオテクノロジー研究センターの古谷祐詞准教授、神取秀樹特別教授、香川大学医学部の藤原祐一郎教授らの研究グループは、イスラエルおよびドイツの研究グループとの国際共同研究により、海洋などの水圏環境に棲む幅広い種類の藻類が、太陽光で駆動しイオンを輸送する機能を有する、巨大なタンパク質を持つことを世界で初めて発見しました。
これは動物の視覚や植物の光合成といった既知のものとは異なった、生物による全く新しい太陽光の利用法の存在を明らかにしたものです。この新しいタンパク質は、我々ヒトをはじめとする動物のほか、微生物などが幅広く有する、光を感知するためのタンパク質である「ロドプシン」と、細胞の多様な場所でイオンを輸送するイオンチャネルタンパク質の一つである「ベストロフィン」の二つが融合した形の分子であり、新たに「ベストロドプシン」と名付けられました。
今後、このベストロドプシンは体の奥深くまで届く長波長光で駆動するという特徴を活かすことで、光で鬱病やてんかんなど脳神経が関わる疾患の発生原因を調べ、さらにそれらの治療法の開発が期待されている光遺伝学分野への応用や、視覚再生医療や光による心疾患治療のための新たな分子ツールとしての利用が期待されます。
本研究成果は、米国東部夏時間2022年6月16日にNature Structural & Molecular Biologyに掲載されました。
全文プレスリリース発表内容:
研究の背景
我々ヒトを含む多くの動物は光があるところで周囲にある物体の形や色を認識する視覚を持ち、一方で植物は太陽光を使って糖を作り出す光合成を行うなど、生物はさまざまな方法でその生存に光のエネルギーを用いていることが古くから知られています。これらを可能としているのが、それぞれの生物種が持つ、光を吸収し、そのエネルギーを生理機能の駆動力として変換する役割を持つ光受容タンパク質と呼ばれる特殊なタンパク質のグループです。動物の視覚の場合はロドプシンと呼ばれるタンパク質が、植物の光合成の場合は光化学系と呼ばれるタンパク質が中心的な役割を果たすことが知られています。
一方で、個々の生物には数千~数万種類のタンパク質が存在すると考えられており、いまだそのほとんどの役割は明らかになっていないことから、その中に既知のものとは異なる光受容タンパク質が存在し、生命がこれまで知られていなかった光の利用形態を持つのかどうかは不明でした。
研究の内容
今回、本研究グループは近年解読された海洋などに棲む藻類のゲノム中の遺伝子配列(注4)に注目し、その中から動物から微生物までの幅広い生物が持ち、光を感知する機能を持つ「ロドプシン」と、細胞の中でイオンを輸送する役割を持つ「ベストロフィン」の二つのタンパク質が融合した、全く新しいタンパク質が広汎な種類の藻類に存在することを見出しました。このタンパク質は新たに「ベストロドプシン」と名付けられました。
まず、本タンパク質を高純度で精製し、その構造を最新の構造解析手法であるクライオ電子顕微鏡(注5)を用いて調べました。その結果、ベストロドプシンは、1~2個のロドプシン部分にベストロフィン部分が連なった構造を持ち、さらにベストロフィン部分同士が5つ集まることで、細胞を構成する脂質二重膜(注6)内で巨大複合体を形成するタンパク質であることが分かりました(図1)。この複合体の中央には脂質二重膜を貫通するチャネルと呼ばれる穴が空いており、このチャネルを通ってイオンが輸送されると考えられました。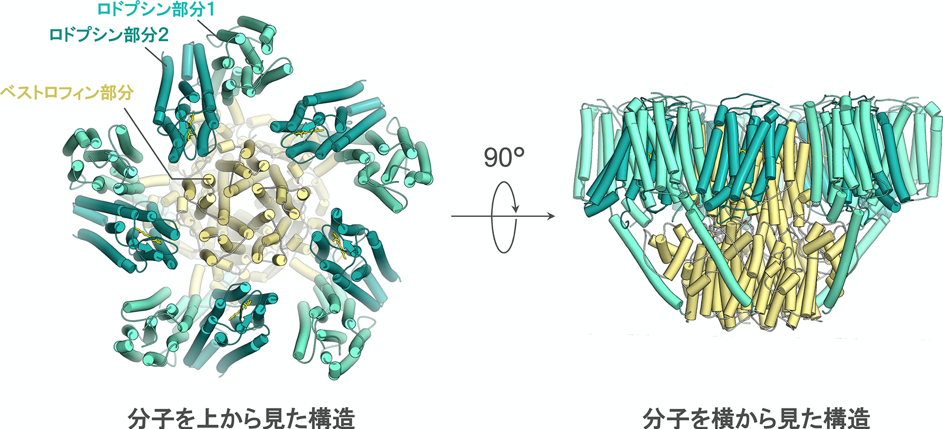
次に、研究グループは実際にベストロドプシンがイオンを輸送するのか、人工的に培養したホ乳類の細胞へ、遺伝子操作によってベストロドプシンの遺伝子を導入し、そのはたらきを調べました。その結果、ベストロドプシンに光を当てると、ロドプシン部分が光のエネルギーを吸収し、それに伴ってベストロフィン部分中央のチャネルが広がり、塩素イオンなどマイナスの電荷を持つイオンの流入が起こることが示されました。これにより、ベストロドプシンは太陽光を用いて巨大なチャネルの開閉を制御することで、藻類の細胞内のイオンの分布を変える、全く新しいタイプの分子であることが明らかになりました。
これまで光エネルギーを使うことで、チャネルを通してイオンを輸送する微生物のロドプシンは数多く知られており、チャネルロドプシンと呼ばれています。しかし、チャネルロドプシンは単一のロドプシン分子からなり、その中のチャネルの径はそれほど大きなものではありませんでした。今回発見されたベストロドプシンの持つチャネルの径は、チャネルロドプシンのものよりも遙かに大きく、より大量のイオン輸送が可能であると考えられています。
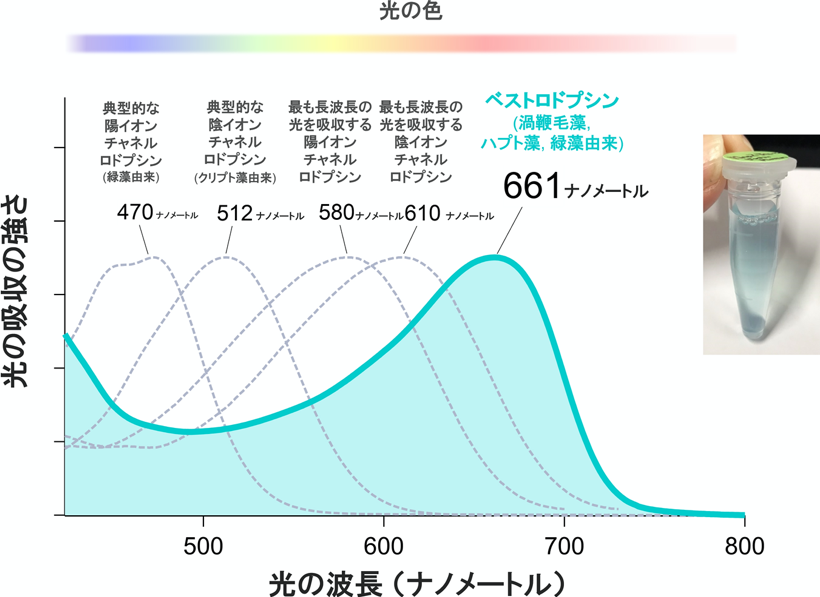
また近年、チャネルロドプシンを動物の脳などの神経細胞に発現させ、光で神経の活動を制御する光遺伝学(オプトジェネティクス)と呼ばれる技術が、神経科学分野や、神経疾患治療の分野などで大きな注目を集めています。しかし、生体組織は多くのチャネルロドプシンが利用する波長の短い可視光を強く散乱してしまうことから、生体深部へその様な光を届けることが難しく、光遺伝学による疾患治療などの実用化に向け大きな障害となっていました。これに対し、ベストロドプシンは661ナノメートル(注7)と、どのチャネルロドプシンよりも長い波長の光を使ってはたらくため、これまで不可能であった体深部の組織中の神経活動の操作や、疾患治療を可能にすると期待されます(図2)。
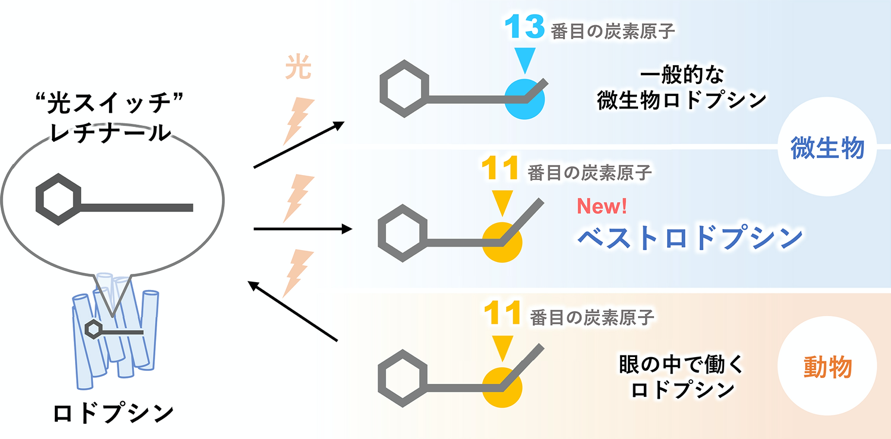
さらに研究グループはどの様にしてロドプシン部分が光を吸収し、イオンチャネルの開閉を制御しているのかその分子メカニズムについても研究を行いました。タンパク質は通常、可視光のエネルギーを利用することができませんが、ロドプシンの場合レチナール(注8)と呼ばれる色素分子が結合しており、このレチナールによって可視光のエネルギーを自身に取り込み、使うことが可能となります。研究グループはレーザーや赤外分光(注9)を用いて、ベストロドプシンのレチナールが光を吸収するとどの様な変化が分子に表れるかを調べました。その結果、光がレチナールに吸収されると、まっすぐ伸びた形をしていたレチナールの構造が、折れ曲がった構造へと変化することが明らかになりました。同様のレチナールの構造の変化は、既知の動物や微生物のロドプシンでも起こることが知られていましたが、折れ曲がり方がそれぞれ異なります。これに対し、ベストロドプシンは微生物が持つ分子でありながら、光を吸収したレチナールが示す折れ曲がり方は動物型のロドプシンと同じものであることが明らかになりました(図3)。ここからベストロドプシンは、一万種以上が知られている微生物のロドプシンの中でも、初めての動物型に似た性質を持つ分子であり、藻類の中で独自の進化を遂げた分子であることが示唆されます。
また、すべてのロドプシンは氷点下200度に冷やしても、光でレチナールが曲がることが知られていましたが、ベストロドプシンは氷点下100度以上にしないと光で反応しないという不思議な性質を持つことが分かりました。赤外分光解析の結果からは、タンパク質内部のアミノ酸残基に由来するプロトン化したカルボン酸の水素結合変化や主鎖の骨格構造の変化が明らかになりました。
以上の結果から、レチナールが折れ曲がる反応の後、ロドプシン部分全体の構造が変わり、それがベストロフィン部分へ伝わることで、複合体中央のチャネルが開くことが分かり、ベストロドプシンが光でイオンの透過を制御する分子メカニズムが明らかになりました(図4)。
今後の展望
今回の研究により、さまざまな藻類が太陽光とベストロドプシンを用いて、細胞内のイオン濃度を自在に制御していることが明らかになりました。藻類のゲノムデータからは約20種類以上のベストロドプシンが見付かった一方で、本研究でその分子的な性質が調べられたのはわずか数種類であり、今後はより多様な性質を持つベストロドプシンが見付かる可能性が期待されます。特に藻類は棲息する環境によって、異なった色の光が太陽から届くことから、今回のものとは異なった色の光ではたらくベストロドプシンを持つことで、生息場所や藻類の種類ごとに多様な光を利用できる様になると考えられ、今後はそれを明らかにする研究が行われる予定です。またマイナスの電荷を持つイオン以外の輸送が可能なベストロドプシンが見付かる可能性もあります。そして、ベストロドプシンによる光依存的なイオン調節が、藻類の生存にどの様に役立つのか、その生理学的な役割を明らかにするための研究も今後行われると期待されます。
一方で、ベストロドプシンは従来のチャネルロドプシンにはない大口径のチャネルと、脳などの生体組織によって散乱されることなく、体の奥深くまで届けることができる長波長の光を利用できる性質を持つことから、光で鬱病やてんかんなど脳神経が関わる疾患の発生原因の研究やそれらの治療法の開発が期待されている光遺伝学分野への応用、視覚再生医療や光による心疾患治療のための新たな分子ツールとしての利用が期待されます。
本研究は、文部科学省日本学術振興会(JSPS) 科学研究費助成事業(学術変革領域研究(B)「低エネルギー操作」における「超音波・磁場感受性レシーバ分子開発と筋組織形成促進技術への応用(研究代表者:井上 圭一、課題番号:JP20H05758)」、特別推進研究「光遺伝学を支えるロドプシンの作動メカニズムの解明(研究代表者:神取 秀樹、課題番号: JP21H04969)」、新学術領域研究「高速分子動画」における「時間分解構造解析を補完する精密顕微分光計測(研究代表者:久保 稔、研究分担者:古谷 祐詞、課題番号:JP19H05784)」)、および科学技術振興機構(JST) 戦略的創造研究推進事業(CREST「光の特性を活用した生命機能の時空間制御技術の開発と応用(研究総括:影山 龍一郎)」における「細胞内二次メッセンジャーの光操作開発と応用(研究代表者:神取 秀樹、課題番号:JPMJCR1753)」、CREST「新たな光機能や光物性の発現・利活用を基軸とする次世代フォトニクスの基盤技術(研究総括:北山 研一)」における「超短赤外パルス光源を用いた顕微イメージング装置の開発と生命科学への応用(研究代表者:藤 貴夫、研究分担者:古谷 祐詞、課題番号:JPMJCR17N5)」、さきがけ「生命機能メカニズム解明のための光操作技術(研究総括:七田 芳則)」における「光OFF型オプシンによる高感度かつ自然な視覚再生(研究代表者:永田 崇、課題番号: JPMJPR1888)」)、さきがけ「量子技術を適用した生命科学基盤の創出(研究総括:瀬藤 光利)」における「構造基盤に立脚した色認識機構および色覚情報伝達機構の解明(研究代表者:片山 耕大、課題番号:JPMJPR19G4)」)による支援を受けて行われました。
発表雑誌:
- 雑誌名:「Nature Structural & Molecular Biology」
- 論文タイトル:「Rhodopsin-bestrophin fusion proteins from unicellular algae form gigantic pentameric ion channels」
- 著者:Andrey Rozenberg‡, Igor Kaczmarczyk‡, Donna Matzov‡, Johannes Vierock‡, Takashi Nagata, Masahiro Sugiura, Kota Katayama, Yuma Kawasaki, Masae Konno, Yujiro Nagasaka, Mako Aoyama, Ishita Das, Efrat Pahima, Jonathan Church, Suliman Adam, Veniamin A. Borin, Ariel Chazan, Sandra Augustin, Jonas Wietek, Julien Dine, Yoav Peleg, Akira Kawanabe, Yuichiro Fujiwara, Ofer Yizhar, Mordechai Sheves, Igor Schapiro, Yuji Furutani, Hideki Kandori, Keiichi Inoue, Peter Hegemann, Oded Béjà*, Moran Shalev-Benami*
‡共筆頭著者 *共同責任著者 - DOI番号:10.1038/s41594-022-00783-x
用語解説:
- (注1)ロドプシン
- 動物から細菌などの微生物まで、幅広い生物種の細胞膜上に存在する太陽光を吸収してさまざまな生物学的機能を発現するタンパク質。動物の持つロドプシンは視覚など光に関わる細胞内信号伝達を行う役割を持つのに対し、微生物の持つロドプシンの多くは光のエネルギーを使ってイオンを輸送する。従ってその機能は互いに大きく異なり、進化的にも全く別系統である。しかしそれにも関わらず、これら2種類のロドプシンは、光を吸収するために共にビタミン A の誘導体であるレチナール色素をタンパク質内部に結合し、7本の膜を貫通するらせん(ヘリックス)からなるタンパク質構造を持つなど多くの共通点がある。
- (注2)ベストロフィン
- ロドプシンと同様に動物から微生物まで、幅広い生物種が持つ、イオンを輸送する機能を持つタンパク質。5つのベストロフィンが集まることで、その中央部にイオンを透過するためのチャネルが形成される。ベストロフィンが輸送するイオンの種類は生物種ごとに異なるが、ヒトの持つベストロフィンは、塩素イオンなどのマイナスの電荷を持つイオンを輸送し、さまざまな器官に存在する。
- (注3)光遺伝学(オプトジェネティクス)
- 神経細胞など、生体組織中の細胞に光応答性タンパク質の遺伝子を導入し、神経活動などの細胞の生理活動を外部からの光照射によって制御する技術。光開閉式のイオンチャネルであるチャネルロドプシンが発見されたことにより、2005年頃から可能となったもので、将来的には視覚再生医療や、体内への機器の挿入を必要としない心疾患治療などへの応用が期待されている。
- (注4)ゲノム中の遺伝子配列
- 個々の生物は数千~数万種のタンパク質を体内に持ち、それらがあらゆる生命活動を可能としている。全てのタンパク質は20種類のアミノ酸が連なってできているが、そのつながり方が細胞内の長大なDNAに、DNAを構成する塩基の配列(遺伝子配列)として記録されており、個々の生物ごとのDNAのセットのことをゲノムと呼ぶ。
- (注5)クライオ電子顕微鏡
- 凍結させた生体試料を用いて、タンパク質や細胞小器官の構造を調べる電子顕微鏡技術。単粒子解析と呼ばれる技術により、複雑で巨大なタンパク質の三次元構造を原子レベルで明らかにすることが可能となり、2017年にこの技術に対してノーベル化学賞が授与された。
- (注6)脂質二重膜
- 細胞や細胞内のミトコンドリアや小胞体、核などの表面は、脂質二重膜と呼ばれる脂質分子でできた膜で覆われている。脂質二重膜の表面や内部には、さまざまなタンパク質が存在し、特にロドプシンやベストロフィンの様に、脂質二重膜を貫通する構造を持つタンパク質は膜タンパク質と呼ばれる。
- (注7)ナノメートル
- 1ナノメートル(1 nm)は、10億分の1メートルに対応する。光の波長の単位にも使われる。
- (注8)レチナール
- 通常アミノ酸は可視領域に吸収を持たないため、アミノ酸で構成されるタンパク質もそれ単体では可視光を利用することができない。それに対してロドプシンはタンパク質内部に、体内の酵素反応でビタミンAから生じるレチナールと呼ばれる色素を結合している。ロドプシンのタンパク質内部にあるレチナールが可視光を吸収するとその折れ曲がり構造が変化し、それを通じてタンパク質部分にも変化が起こり、さまざまな生理機能を発現することが可能になる。
- (注9)赤外分光
- 赤外光はヒトの目で見ることのできる可視光より長く、電磁波より短い波長域に波長を持つ光の総称である。赤外分光ではさまざまな波長の赤外光の試料による吸収の強さを見ることで、分子の構造や分子間相互作用の強さなどを調べることができ、特に試料がタンパク質の場合はタンパク質を構成するアミノ酸の微小な構造の違いや骨格構造の変化を見分けることができる。